Experimento 03
Plasmólise

Plasmólise é a condição em que o protoplasto se desprende da parede celular, devido à saída de água do protoplasto por osmose; essencialmente é um fenômeno de laboratório, com possíveis exceções em condições extremas de estresse salino ou de água, que raramente ocorrem na natureza. As células vegetais acumulam em seus vacúolos soluções relativamente concentradas em sais, e também podem acumular açúcares, ácidos orgânicos e aminoácidos. Uma das consequências é o aumento da pressão hidrostática no interior das células devido à entrada constante dá agua por osmose. Essa pressão contra a parede celular mantém a célula turgida. Consequentemente, a pressão hidrostática em uma célula vegetal é geralmente referida como a pressão de turgor que é definida como a pressão que se desenvolve no interior de uma célula vegetal como resultado da osmose e/ou embebição. Igual e oposta à pressão de turgor em qualquer momento é a pressão mecânica da parede celular, dirigida para o interior da célula, chamada de pressão da parede.
O turgor em um vegetal é especialmente importante como suporte para as regiões não-lenhosas de uma planta. Quase todo o crescimento de uma célula vegetal resulta da absorção de água, com a maior parte do aumento em tamanho da célula resultante do aumento de tamanho dos vacúolos. O turgor é mantido nas células vegetais porque a maioria das células existe em meios com potencial hídrico relativamente elevado.
Por outro lado, se uma célula vegetal é colocada em uma solução com potencial hídrico relativamente baixo, a água então sairá da célula por osmose, e o vacúolo e protoplasto irão se retrair, desse modo a membrana será afastada da parede celular. O processo pode ser revertido se, em seguida, a célula for transferida para a água pura. A partir desses processos é possível determinar a turgidez da célula, assim como as taxas de soluto que estão atravessando a membrana celular.
Vídeo - Plasmólise
Roteiro experimentação Plasmólise
OBJETIVO: Verificar a ocorrência de plasmólise
MATERIAL: placas de Petri, água destilada soluções de sacarose (0,3M, 0,4M, 0,5M, 0,6M, 0,7M, 0,8M, 0,9M, 1,0M), epiderme inferior de folha de Zebrina pendula, microscópio, laminas, lamínulas.
PROCEDIMENTOS:
1) Coloque 20ml de agua destilada em uma das placas e nas demais as concentrações de sacarose correspondente, mantenhas as placas tampadas;
2) Coloque em cada uma das placas 2 a 3 pedaços de epiderme inferior de folha de Zebrina pendula
3) Após cinco minutos monte uma lamina com lamínula com todas as concentrações iniciando pela agua destilada e observe no microscópio e desenhe
4) Determine em quais concentrações pode ser observada a plasmólise.
Responder:
Em quais concentrações houve a plasmólise?
Qual o processo que ocorreu?
Experimento 04
Geotropismo

Tropismo é uma resposta de crescimento envolvendo a curvatura de uma parte de uma planta na mesma direção (positiva) ou em direção oposta (negativa) a um estimulo externo. O geotropismo, ou gravitropismo é o crescimento em resposta à gravidade. Os amiloplastos (estatólitos), presentes em muitas células vegetais, servem como sensores à gravidade. As células especializadas em perceber o estímulo gravitacional nas quais eles ocorrem são chamadas estatócitos.
Se uma plântula é colocada na posição horizontal, suas raízes crescerão para baixo (geotropismo positivo) e seu sistema caulinar crescerá para cima (geotropismo negativo), comportamento é extremamente crítico nos estágios iniciais de germinação. Isso se deve ao fato de as raízes serem mais sensíveis a auxina do que os caules, e em altas concentrações de auxina, o crescimento das raízes é inibido.
Os tecidos abaixo do ápice também são capazes de responder à gravidade. Ao contrario da luz unilateral, a gravidade não forma um gradiente entre as metades inferiores e superiores de um órgão. Todas as partes da planta percebem igualmente um estimulo gravitacional. A parte inferior do caule colocado na posição horizontal é estimulada pela auxina e cresce mais rapidamente do que o respectivo lado superior. O resultado disso é uma curvatura dos caules para cima. Para a raiz, o nível relativamente elevado de auxina no lado inferior inibe o crescimento, ocasionando assim o encurvamento deste órgão para baixo.
Roteiro experimentação geotropismo
OBJETIVO: Observar o movimento da planta em direção a luz
MATERIAL: Planta envasada de crescimento rápido (feijão, batata, etc)
PROCEDIMENTOS:
1) Escolha uma planta que esteja na fase vegetativa e deixe o vaso de modo que a planta fique na posição horizontal. Mantenha o substrato umedecido.
2) Coloque o vaso em câmara escura.
3) Observe diariamente durante uma semana o que esta ocorrendo, marque em folha de papel as curvaturas que a planta seguiu.
Responder:
O que foi observado com o ângulo da planta?
Como você explica o que observou?
Por que o experimento foi realizado no escuro?
Experimento 06
Fotoperiodismo

O fotoperíodo é o comprimento relativo do dia e da noite. Já o fotoperiodismo representa a habilidade de um organismo, em detectar e responder às variações do comprimento dos dias, ou seja, é uma resposta biológica a uma mudança nas proporções de luz e escuro num ciclo diário de 24horas.
As respostas das plantas controladas pelo comprimento do dia são numerosas, incluindo a iniciação do florescimento, a reprodução assexual, a formação de órgãos de reserva e a indução de dormência. Talvez todas as respostas fotoperiódicas das plantas utilizem os mesmos fotorreceptores, com rotas de transdução de sinais subsequentes especificas que regulam respostas diferentes.
A classificação das plantas de acordo com suas respostas fotoperiódicas está baseada no florescimento, embora muitos outros aspectos do desenvolvimento das plantas possam também ser afetados pelo comprimento do dia. Elas podem ser agrupadas em três tipos gerais, plantas de dias longos, plantas de dias curtos e plantas neutras. A distinção essencial entre as plantas é que o florescimento nas plantas de dias longos é estimulado somente quando o comprimento do dia excede uma certa duração, chamada de comprimento crítico do dia, em cada ciclo de 24 horas, enquanto a estimulação do florescimento nas plantas de dias curtos requer um comprimento de dia menor do que o comprimento critico do dia. O valor do comprimento crítico do dia varia amplamente entre as espécies.
As plantas de dias longos florescem somente em dias em que o período de luz for mais longo ou tem florescimento acelerado por dias longos. Estas tem ocorrência principalmente no verão. Por muitos anos, os fisiologistas vegetais acreditaram que a correlação entre os dias longos e o florescimento era uma consequência da acumulação de produtos da fotossíntese sintetizados durante aqueles dias. As plantas de dias curtos florescem apenas em dias curtos, ou tem florescimento acelerado por dias curtos. São características do início da primavera ou outono, pois passam por um período de luz menor do que um comprimento crítico. Tem-se ainda as plantas de dias neutros, que florescem independentemente da condição de fotoperíodo, são insensíveis ao comprimento do dia. Seu florescimento está tipicamente sob regulação autônoma, isto é, controle do desenvolvimento interno.
O fator mais importante para o desenvolvimento de uma planta não é o comprimento absoluto do fotoperíodo, mas sim se este é mais longo ou curto do que um certo intervalo crítico. As plantas exibem várias adaptações para evitar a ambiguidade do sinal do comprimento do dia. Uma delas é a ligação da exigência de temperatura a uma resposta fotoperiódica. Certas espécies de plantas não respondem ao fotoperíodo, até que tenha ocorrido um período de frio.
Sob condições naturais, os comprimentos do dia e da noite configuram um ciclo de 24 horas de luz e escuro. Em princípio, uma planta poderia perceber um comprimento crítico do dia pela medição da duração tanto da luz quanto do escuro. É possível induzir o florescimento nessas plantas com períodos de luz mais longos do que o valor crítico, desde que os mesmos sejam seguidos por noites suficientemente longas. Da mesma forma, tais plantas não florescem quando dias curtos são seguidos por noites curtas, após tal indução. As plantas de dias longos florescem em dias curtos, desde que o comprimento da noite seja também curto, por indução. Contudo, um regime de dias longos seguidos por noites longas não surge efeito em tais plantas induzidas.
O período de escuro pode se tornar não efetivo pela interrupção com uma curta exposição à luz, chamada de quebra da noite. Por outro lado, a interrupção de um dia longo com um breve período de escuro não cancela o efeito do dia longo. Tratamentos de quebra da noite de apenas poucos minutos são efetivos no impedimento do florescimento de muitas espécies de dias curtos, mas exposições muito mais longas são necessárias para promover o florescimento em plantas de dias longos
Roteiro experimentação fotoperiodismo
OBJETIVO: Discutir eventos fisiológicos influenciados pela luz
MATERIAL: Sementes de feijão e milho, potes de plástico, areia lavada.
PROCEDIMENTOS:
1) Coloque 5 sementes de feijão em cada pote contendo areia lavada com no mínimo oito repetições.
2) Mantenha quatro potes em luz plena e os outros no escuro total.
3) Repita o mesmo procedimento com as sementes de milho.
4) Observar após cinco das o efeito da luz (presença e ausência) sobre o desenvolvimento das plântulas, destacando a mudança no padrão do desenvolvimento.
5) Elaborar uma tabela comparando as plântulas de feijão crescidas na presença e ausência de luz , o mesmo deverá ser feito com as plântulas de milho.
|
Características observadas |
Feijão |
Milho |
||
|
Escuro |
Luz |
Escuro |
Luz |
|
|
Pigmentação |
|
|
|
|
|
Rigidez caulinar |
|
|
|
|
|
Sistema radicular |
|
|
|
|
|
Folhas primárias |
|
|
|
|
|
|
|
|
|
|
|
Comprimento do hipocótilo |
|
|
|
|
|
Comprimento do epicótilo |
|
|
|
|
|
Gancho plumular |
|
|
|
|
|
Comprimento do mesocótilo |
|
|
|
|
|
Comprimento do coleópitile |
|
|
|
|
Experimento 05
Pigmentos (Clorofila)

Um pigmento é qualquer substância que absorve luz visível. Alguns pigmentos absorvem todos os comprimentos de onda da luz e, portanto, apresentam-se negros. Entretanto, a maior parte absorve apenas certos comprimentos de onda, transmitindo ou refletindo os comprimentos de onda não absorvidos. A clorofila é o pigmento que confere a cor verde às folhas. Isso ocorre devido a sua absorção principalmente de luz nos comprimentos de onda violeta e azul bem como no vermelho. A absorção da luz azul excita a clorofila a um estado energético mais elevado que a absorção de luz vermelha, pois a energia dos fótons é maior quando seus comprimentos de onda são menores.
Uma evidência de que a clorofila é o principal pigmento envolvido na fotossíntese é a similaridade entre o espectro de absorção e o espectro de ação da fotossíntese. No estado excitado, a clorofila é extremamente instável e rapidamente libera parte de sua energia ao meio como calor, entrando em um estado de menor excitação de alguns nanossegundos. No estado de menor excitação, a clorofila excitada libera energia como calor, como fluorescência, como transferência de energia ou provocando a ocorrência de reações químicas (processo fotoquímico). A luz é absorvida, principalmente pelos complexos-antena, os quais são compostos por clorofilas, pigmentos acessórios e proteínas, estando localizados nas membranas dos tilacóides dos cloroplastos.
Os centros de reação, que contém complexos proteicos com muitas subunidades e uma quantidade massiva de clorofila, iniciam uma série de reações químicas complexas que capturam energia na forma de ligações químicas. A energia da luz solar é primeiramente absorvida pelos pigmentos da planta. Todos os pigmentos ativos no processo de fotossíntese são encontrados nos cloroplastos. As clorofilas e as bacterioclorofilas (pigmentos encontrados em algumas bactérias) são os pigmentos típicos dos organismos fotossintéticos, mas todos os organismos possuem uma mistura de mais de um tipo de pigmento, cada um desempenhando uma função específica. As clorofilas a e b são abundantes nas plantas verdes, e as c e d são encontradas em alguns protistas e cianobactérias.
Os carotenoides são encontrados nos organismos fotossintéticos, e constituem integralmente as membranas dos tilacoides e estão, em geral, intimamente associados aos pigmentos protéicos das antenas e dos centros de reação. A luz absorvida pelos carotenóides é transferida à clorofila para o processo de fotossíntese e em decorrência do papel que desempenham são chamados de pigmentos acessórios.
Vídeo - Propriedade das Clorofilas
Roteiro experimentação pigmentos
Separação dos Pigmentos Vegetais Foliares por Cromatografia de Papel
Objetivo: Identificar qualitativamente os pigmentos obtidos do extrato orgânico de folhas verdes.
Material:Folhas verdes de espinafre, papel alumínio, gral com pistilo, funil, provetas, béquer, pipetas, papel filtro, bastão de vidro, durex, papel cromatográfico Whatmann n° 1, Reagentes: acetona, álcool etílico, éter de petróleo
Procedimento:
1) Preparar 60 ml, numa proporção de 1:1:1, de éter de petróleo, acetona e etanol.
2) Macerar algumas folhas de espinafre.
3) Adicionar o solvente.
4) Retirar o extrato de pigmentos, colocando na cuba cromatográfica.
5) Colocar uma tira de papel cromatográfico dentro da cuba em contato com o extrato.
6) Esperar algum tempo para observar.
Propriedade das Clorofilas
Objetivo: Demonstrar algumas propriedades das clorofilas.
Material:Folhas verdes de espinafre, tubos de ensaio e suportes, gral com pistilo, etiquetas, provetas, pipetas, funil, papel filtro, Reagentes: álcool etílico, água oxigenada, benzina e ácido acético.
Procedimento:
1) Macerar algumas folhas de espinafre e acrescentar ao macerado 40 ml de álcool.
2) Filtrar.
3) Transferir o filtrado para 4 tubos de ensaio (manter a mesma quantidade nos tubos).
4) Observar:
Tubo 1 : controle. Observar fluorescência (Só com bastante luz solar).
Tubo 2: adicionar 2 ml de ácido acético. Observar feofitinas.
Tubo 3 : adicionar 4 ml de água oxigenada. Observar oxigenação.
Tubo 4 : adicionar 6 ml de benzina. Observar a separação dos pigmentos.
Experimento 07
Germinação
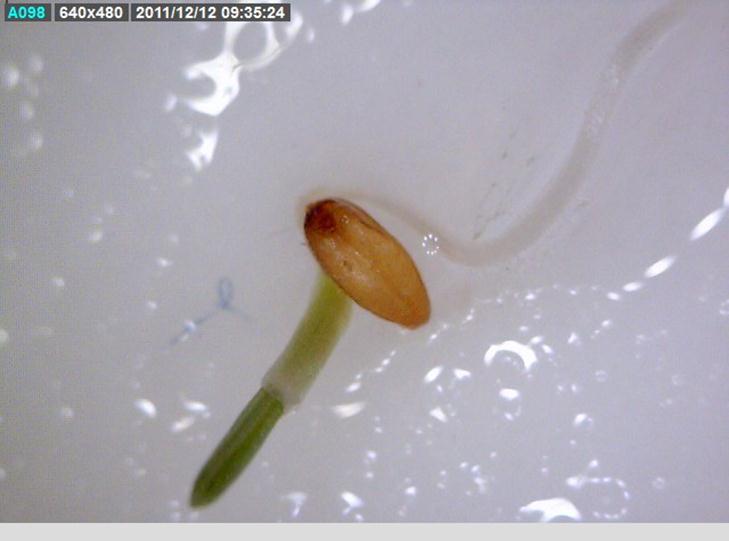
A palavra germinação refere-se ao conjunto de processos associados à fase inicial ou de retomada do crescimento de uma estrutura da planta. O crescimento do embrião é o mesmo que a germinação da semente. Durante a fase inicial do processo de desenvolvimento, que inicia com a entrada de água na semente (embebição), o metabolismo será ativado, e quando há o rompimento do tegumento, a respiração que até então era anaeróbica passa a ser aeróbica, requerendo oxigênio. De acordo com o critério fisiológico, a germinação é completa quando uma parte do embrião, em geral a radícula, penetra e trespassa os tecidos que o envolvem.
As sementes normalmente germinam no solo em ausência de luz. Se as sementes são germinadas no escuro, os proplastídeos se diferenciam em estioplastos, os quais apresentam arranjos semicristalinos tubulares de membranas conhecidos como corpos pró-lamelares. Em vez da clorofila, os estioplástos contém um pigmento precursor, de cor verde-amarelada, o protoclorofilida.
Embora muitas sementes germinem dentro de uma ampla faixa de temperatura, elas geralmente não germinarão abaixo ou acima de uma certa faixa específica de temperatura para a espécie. Algumas não germinam mesmo quando as condições externas são favoráveis, sendo chamadas dormentes. Essa dormência pode muitas vezes ser quebrada pela aplicação de giberelina (grupo de hormônios associados à promoção do crescimento do caule). Visto que as mudanças nos níveis de giberelinas são frequentemente, mas não sempre, observadas em resposta ao resfriamento, elas podem representar um regulador natural de um ou mais processos envolvidos na germinação entre elas: a ativação do crescimento vegetativo do embrião, o enfraquecimentro da camada do endosperma que envolve o embrião e restringe seu crescimento e a mobilização das reservas energéticas do endosperma.
Cada espécie de semente tem um certo período de viabilidade. Algumas espécies possuem sementes que precisam germinar no máximo duas semanas após sua dispersão. Outras (gênero Lótus) são conhecidas por terem até 2000 anos de idade e ainda serem capazes de germinar. No caso de uma semente ainda ser viável, o embrião dentro dela necessita algo para que seu metabolismo se mantenha ativo e inicie o processo de crescimento.
Vídeo - Germinação de Capim-annoni (Eragrostis plana Ness)
Roteiro experimentação germinação
OBJETIVO: Observar o efeito da temperatura em diferentes espécies
MATERIAL: Sementes de feijão, milho, alface, ervilha, caixas tipo Gerbox® ou placas de Petri, papel para germinação, germinador, água destilada.
PROCEDIMENTOS:
1) Prepare dois lotes de sementes de cada espécie com no mínimo quatro repetições, submetendo-as ao seguintes tratamento: 10 lote coloque em temperatura ambiente registrando a temperatura diariamente, 20 lote submeta a temperaturas diferentes variando de 100C a 300C.
2) Coloque as sementes conforme as Regras de Analise de Sementes (RAS) e mantenha de acordo com o tratamento.
3) Observe a germinação seguindo a RAS.
Página 2 de 4




